 联系我们
联系我们
 18210828691
18210828691


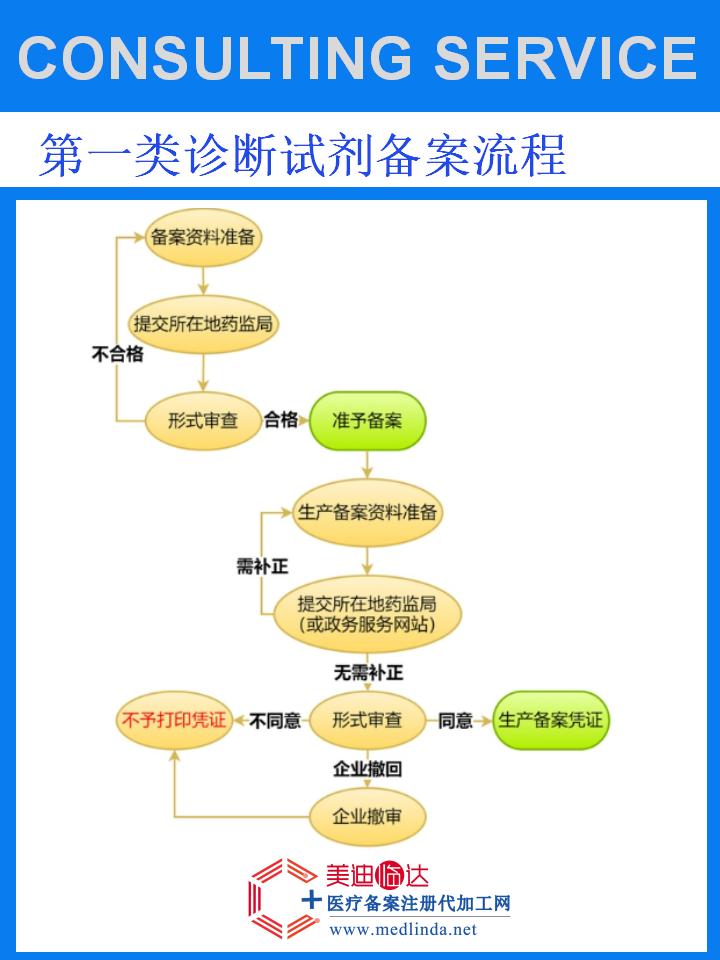





【图文】办理卵磷脂吐温胰蛋白胨大豆培养基医疗器械产品备案路径指导:精准导航,合规前行
在医疗科技日新月异的今天,卵磷脂吐温胰蛋白胨大豆培养基作为一种高性能的微生物培养基,其重要性不言而喻。它以其独特的配方设计,为微生物学实验提供了理想的生长环境,广泛应用于细菌培养、鉴定及药敏试验中。随着#热门话题“医疗器械监管趋严”的深入讨论,办理卵磷脂吐温胰蛋白胨大豆培养基的医疗器械产品备案成为了企业不可回避的重要任务。本文将为您详细指引备案路径,助您轻松跨越合规门槛。
医疗器械产品备案是国家对医疗器械市场进行监管的重要手段,旨在保障医疗器械的安全性、有效性和质量可控性。对于卵磷脂吐温胰蛋白胨大豆培养基这类关键诊断试剂而言,完成备案不仅是法律法规的硬性要求,更是企业信誉与产品质量的体现。
政策学习与理解:
首先,企业需深入研读国家关于医疗器械产品备案的相关政策法规,明确备案的适用范围、条件、流程及所需材料。特别关注最新政策动态,确保备案工作的时效性和准确性。
资料准备与整理:
根据备案要求,准备并整理企业资质证明、产品说明书、生产工艺流程、质量控制标准、检测报告等必要材料。确保所有资料真实、完整、准确,符合法规要求。
在线申报与提交:
通过国家药品监督管理局指定的医疗器械注册管理信息系统进行在线申报,提交备案申请及相关材料。在申报过程中,注意填写信息的准确性和规范性,避免因信息错误导致审核延误。
审核与反馈:
监管部门将对提交的备案申请进行审核,包括对资料完整性、真实性及合规性的审查。企业需保持与监管部门的沟通联系,及时解答疑问并提供补充材料。审核通过后,监管部门将进行公示并颁发备案凭证。
后续监管与维护:
获得备案凭证后,企业需继续遵守相关法规要求,加强产品质量管理,确保产品持续符合备案标准。同时,关注政策变化和市场动态,及时调整备案策略和产品布局。
办理卵磷脂吐温胰蛋白胨大豆培养基医疗器械产品备案是一项复杂而重要的工作。通过精准导航备案路径、严格遵循法规要求、强化质量控制和优化客户服务,企业可以顺利跨越合规门槛,为产品的市场准入奠定坚实基础。让我们携手并进,在医疗器械市场的广阔天地中共同书写辉煌篇章!